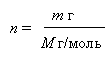ХИМИЯ В 121-Й
|
Меню сайта
Наш опрос
Статистика
Онлайн всего: 1 Гостей: 1 Пользователей: 0 |
Количество вещества. Моль. Молярная масса.Количество вещества. Моль. Допустим, мы знаем, что вещества А и Б реагируют между собой с образованием продукта В. Другими словами, нам известно уравнение химической реакции: А + Б = В Примером может послужить уже встречавшаяся нам простая реакция: СаО + Н2О = Са(ОН)2 Остается взять нужные количества А (CaO) и Б (H2O) и провести реакцию. Итак, сколько нужно взвесить А и сколько Б, чтобы реакция прошла до конца и не осталось никаких исходных веществ? Если мы возьмем одинаковые по весу образцы А и Б, то цели не достигнем – продукт В обязательно будет загрязнен одним из исходных веществ. Почему это произойдет? Дело в том, что простейшие структурные единицы веществ А и Б состоят из разных наборов атомов – CaO и Н2О.Эти наборы атомов различаются по массе. Значит, в 1 г СаО окажется одно количество частиц, а в 1 г Н2О – другое. При реакции между ними останутся неизрасходованными частицы одного из исходных веществ. Для работы химикам удобно брать вещества такими порциями, которые содержали бы одинаковое количество молекул. Допустим, химик взял порцию СаО, в которой содержится N "молекул" этого вещества. Затем берется некая порция воды, в которой тоже N молекул. Смешав эти две порции реагентов, химик получает порцию продукта, в которой будет тоже ровно N "молекул" Са(ОН)2:
Здесь N "молекул" СаО, N молекул Н2О, N "молекул" Са(ОН)2 После окончания реакции не останется ни СаО, ни Н2О – они полностью превратились в Са(ОН)2. Легко сосчитать определенное количество яблок, конфет или монеток, но молекулы отсчитывать затруднительно. Это можно делать путем взвешивания вещества. Например, работники банков знают, что в 1 кг 10-копеечных монет окажется 540 таких монет. То же самое можно проделать с молекулами. Допустим, нам известно, что N молекул весят М г. Достаточно взвесить на весах М г этого вещества, чтобы быть уверенным, что мы отмерили N молекул этого вещества. Но как узнать величину М в граммах? Масса молекул складывается из масс составляющих ее атомов. Атомные массы (атомные веса) элементов мы можем узнать из Периодической таблицы. Атомный вес Са – 40 а.е.м., а атомный вес кислорода – 16 а.е.м. Следовательно, молекулярный вес (молекулярная масса) СаО составит: 40 а.е.м. (Ca) + 16 а.е.м. (O) = 56 а.е.м. (CaO) Допустим, мы решили взять для проведения реакции 10 "молекул" СаО и 10 молекул Н2О. Удобно ли нам будет работать с такими малыми количествами вещества? Разумеется, нет. Тогда попробуем взвесить на весах по миллиону (1000000) молекул каждого реагента. В принципе, можно сосчитать, сколько весит порция из миллиона "молекул" СаО. Мы знаем, что 1 а.е.м. = 1,67.10-27 кг Мы получим вес (в граммах) порции из миллиона "молекул" СаО: 93,5.10-24 г× 1 000 000 = 93,5× 10-18 г. Если вспомнить, что наибольшая точность обычных лабораторных весов составляет 1 мг (это всего лишь 10-3 г), то обнаружится, что и миллион "молекул" СаО - совсем неудобная "порция” для взвешивания на весах. Значит, надо выбрать для работы не миллион, а какую-то другую, более удобную порцию из N молекул. Видимо, это число N должно быть намного больше миллиона. Оказывается, очень удобной является порция из 6.1023 частиц (молекул, атомов, ионов и т.д.). Обозначим ее буквой N (чтобы отличать от любых других порций N. Если N равно именно такому числу частиц (6.1023), то их вес в граммах числено равен весу этих частиц в а.е.м. Другими словами, чтобы перейти от измерений в а.е.м. к измерениям в граммах, достаточно увеличить шкалу измерений в 6.1023 раз! 6× 1023 а.е.м. = 1 г Число N = 6.1023 является как бы переводным коэффициентом из шкалы а.е.м. в шкалу граммов. Например, молекулярный вес CaO составляет 56 а.е.м. Взвесив на весах 56 г оксида кальция СаО, мы тем самым "отсчитали" 6.1023 структурных единиц ("молекул") СаО. Чтобы теперь отсчитать для нашей реакции точно такое же количество молекул Н2О, следует взвесить на весах ровно 18 г воды: 1+1 а.е.м (вес двух атомов Н) + 16 а.е.м. (вес одного атома О) = 18 а.е.м. (H2O) 18 а.е.м. .6.1023 = 18 г. Понятно, что взвесив 18 г воды, мы тем самым берем нужные нам 6.1023 молекул воды.
Такие порции из 6.1023 структурных единиц вещества (атомов, молекул, ионов) называются МОЛЕМ вещества. Таким образом, МОЛЬ – это мера количества вещества. Более точное, не округленное количество частиц вещества в 1 моле составляет 6,022045.1023 частиц. С точностью до второго знака после запятой (6,02.1023) эту величину нужно хорошенько запомнить. МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества. Примеры: 1 моль (1 М) воды = 6.1023 молекул Н2О, 1 моль (1 М) железа = 6.1023 атомов Fe, 1 моль (1 М) хлора = 6.1023 молекул Cl2, 1 моль (1 М) ионов хлора Cl- = 6.1023 ионов Cl-. 1 моль (1 М) электронов е- = 6.1023 электронов е-. Теперь мы имеем удобную единицу количества вещества моль, с помощью которой легко отмерять равные порции молекул или атомов простым взвешиванием. Разумеется, если мы увеличим или уменьшим взятое нами количество воды (18 г) и оксида кальция (56 г) в одинаковое количество раз, то и порции реагирующих молекул уменьшатся или возрастут во столько же раз. Допустим, 1,8 г воды полностью прореагируют с 5,6 г СаО, а 180 г Н2О тоже без остатка прореагируют с 560 г СаО. Другими словами 0,1 моль воды прореагирует с 0,1 моль СаО, а 10 моль воды прореагируют с 10 моль СаО и т.д. Как мы видим, масса одного моля какого-нибудь вещества (в граммах) числено совпадает с молекулярной или атомной массой этого вещества (в а.е.м. или в безразмерном выражении - как в случае относительной атомной или молекулярной массы). Это очень удобно для химических расчетов. Например, молекулярная масса (молекулярный вес) метана CH4 составляет (12 + 4) = 16 а.е.м. Тогда для реакции горения метана: CH4 + 2O2 = CO2 + 2H2O справедливо, что из 1 моля метана получаются 2 моля воды и что из 16 г метана получается 2.18 = 36 г воды. Молярная масса вещества. Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ. Она обозначается буквой М и имеет размерность г/моль. Количество молей вещества n находят из отношения массы m этого вещества (г) к его молярной массе М (г/моль).
Например, число молей в m г воды составляет: n = m/18. Для m г металлического натрия: n = m/23, и так далее. И наоборот, массу вещества определяют как произведение молярной массы на количество вещества: m = n . M. Так, масса 0,1 моля Na составляет 0,1 моль×23 г/моль = 2,3 г. Молярная масса численно всегда совпадает с молекулярной массой (или атомной массой - если вещество состоит не из молекул, а из атомов). В таблице 5-1 для иллюстрации приведены молярные массы М для нескольких веществ разного строения. Молярная масса М – постоянная величина для каждого конкретного вещества. Без неё не обойтись при вычислении количества молей (n). Однако в дальнейшем для нас основным рабочим инструментом будет именно МОЛЬ вещества. (по материалам сайта http://www.hemi.nsu.ru) Задания для самостоятельной работы. 1. Задачи на вычисление количества вещества и молярной массы. |
Поиск
Календарь
Архив записей
Друзья сайта
|
||||||||||||||||||||||||||||||||||||||||||||
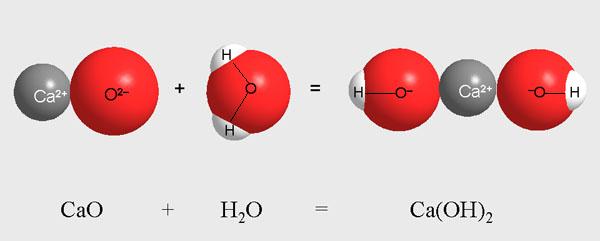
 Смешав точно 56 г СаО и 18 г Н2О, мы смешиваем порции веществ, в которых число структурных единиц CaO и H2O абсолютно одинаково. Тем самым мы обеспечиваем полное протекание реакции. В продукте реакции – Са(ОН)2 – не должно остаться непрореагировавших CaO и H2O.
Смешав точно 56 г СаО и 18 г Н2О, мы смешиваем порции веществ, в которых число структурных единиц CaO и H2O абсолютно одинаково. Тем самым мы обеспечиваем полное протекание реакции. В продукте реакции – Са(ОН)2 – не должно остаться непрореагировавших CaO и H2O.